Nuestra profesora Susana Estrada nos explica la técnica Tinción de Gram, cuyo conocimiento es imprescindible tanto para los alumnos de Técnico de Dietética como para los alumnos de Técnico Superior de Laboratorio Clínico y Biomédico.
¿En qué consiste la Tinción de Gram?
La Tinción de Gram consiste en una técnica de laboratorio diseñada por Christian Gramen el año 1884. El objetivo de Gram era conseguir una prueba con la que fuera posible diferenciar diferentes grupos de bacterias para así poder estudiarlas y clasificarlas.
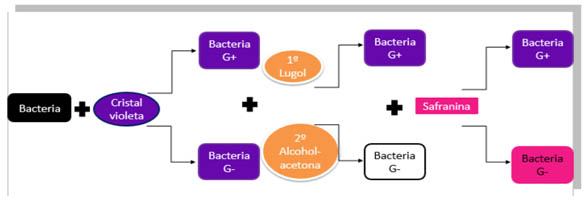
Según la distribución del peptidoglicano de la pared celular que las envuelve, se tiñen de una forma u otra.
Así, las bacterias que no se tiñen mediante esta técnica se denominan Gram negativas. Están formadas por una pared más fina formada por menos capas de peptidoglicano y una segunda membrana rica en lípidos (que repele la tinción Gram), al microscopio aparecen incoloras.
El cristal violeta se une a la pared bacteriana y se estabiliza con el lugol. La mezcla alcohol-acetona disuelve la membrana externa de las bacterias Gram negativas (más fina que la de las Gram positivas) extrayéndose el cristal violeta. Después se tiñen solo las Gram negativas con safranina.
¡Recibe tu PDF con información sobre el Ciclo de Técnico Superior en Laboratorio Clínico y Biomédico modalidad presencial en Kapital Inteligente!:
Material necesario:
- Placa Petri con agar chocolate
- Asa de siembra o material estéril para sembrar
- Mechero de alcohol
- Agua destilada
- Colorantes de tinción Gram (cristal violeta, lugol, alcohol-acetona 1:1, safranina)
- Cristalizador y varillas de tinción
- Portaobjetos
- Alcohol 96º
- Papel secante
- Microscopio óptico
Procedimiento Tinción de Gram
En primer lugar, para realizar una tinción, lo que tenemos que tener son microorganismos sembrados. Dichos microorganismos los hemos el día anterior mediante la técnica de siembra de estría múltiple, los hemos dejado incubar durante 24 horas a 37ºC en la incubadora para así obtener las colonias de los diferentes microorganismos. En este caso son microorganismos de la orofaringe.
Siempre que “destapemos” una placa con colonias, deberá hacerse en condiciones de esterilidad. Para conseguir estas condiciones podemos utilizar un mechero Bunsen o un mechero de alcohol. Con el mechero, conseguiremos que se forme un ambiente de esterilidad alrededor de la llama, por lo tanto, si trabajamos cerca del mechero, tendremos un ambiente estéril.

A la hora de comenzar con la tinción, lo primero que hay que realizar es un frotis del microorganismo, para ello hay que añadir una gota pequeña de agua destilada (cuanto mayor sea la gota, tardará más tiempo en secarse).

Debemos coger la muestra con el asa bacteriológica previamente esterilizada. Para ello encendemos el mechero de alcohol y ponemos el asa en posición vertical encima del mechero hasta que el hilo del extremo del asa se quede totalmente incandescente.

Después debemos esperar a que se enfríe porque si tocamos con el hilo incandescente las colonias podemos matar al microorganismo.
Abrimos la placa con las bacterias y con el asa tocamos en el agar para comprobar que éste está frío.
A continuación, cogemos unas colonias de las bacterias y las extendemos sobre la gota de agua destilada.

Una vez extendido, volvemos a esterilizar el asa, ya que todo material debe ser esterilizado antes de volver a ser guardado. A continuación, lo que tenemos que hacer es fijar la muestra, la cual se puede fijar con metanol o se puede fijar con calor. En este caso utilizaremos la fijación por calor.
Tenemos que hacer movimientos circulares o en zig zag por encima de la llama del mechero, levantando constantemente la muestra para que no se nos queme el tiempo suficiente para que la muestra quede totalmente seca y por lo tanto fijada.

Una vez fijada la muestra apagamos el mechero por seguridad.
Ahora, vamos a teñir nuestra siembra de microorganismos en el portaobjeto con diferentes tipos de tinciones para poder visualizar cada microorganismo (bacteria) al microscopio.
Las tinciones se realizan en un cristalizador, también utilizamos varillas de tinciones y el porta con la muestra.

Vamos a utilizar diferentes reactivos para la tinción. En primer lugar el cristal violeta, en segundo lugar el lugol,

usaremos también alcohol de 96º (el decolorante puede estar formado por una mezcla de alcohol, alcohol-acetona y por diferentes mezclas),

y por último la safranina.

¿Qué va a ocurrir? Las bacterias gram positivas y las bacterias gram negativas tienen diferente grosor en el peptidoglicano de su pared celular, de tal forma que cuando echemos el cristal violeta se nos van a teñir tanto las gram positivas como las gram negativas. El lugol lo que hará, será fijar el colorante del cristal violeta a las bacterias, con el alcohol (o mezcla decolorante), lo que haremos será eliminar el cristal violeta de las gram negativas y por último, la safranina, va a teñir solamente a las gram negativas que son las que están decoloradas. Por lo tanto, las gram positivas estarán teñidas de cristal violeta y las gram negativas de safranina (color fucsia).
El protocolo será aplicar a las bacterias fijadas cristal violeta durante un minuto, luego lavar con el frasco lavador. A continuación, añadir lugol durante un minuto, volver a lavar con el frasco lavador. Después, añadir durante 10 o 15 segundos la mezcla de alcohol o alcohol-acetona…, lavar la muestra con el frasco lavador. Y finalmente, añadir safranina durante un minuto y lavar con agua destilada.
Por lo tanto, tal y como hemos dicho, aplicamos el cristal violeta.

Una vez que ha transcurrido el minuto lo lavamos con agua destilada.

Ahora vamos a añadir el lugol justo por encima de la zona de la muestra y esperamos otro minuto.

Ya ha transcurrido el minuto y lavamos con agua destilada. A continuación decoloraremos la muestra con el alcohol. Para conseguirlo hay que incorporar el porta de un lado para ir añadiendo el alcohol y que vaya resbalando para abajo. Cada protocolo estipula un tiempo pero con 15 segundos aproximadamente la muestra quedará decolorada.

Tras los 15 segundos de decoloración, aclararemos con agua destilada para que el alcohol no siga actuación, porque si no paramos el proceso de decoloración a tiempo, todas las bacteria quedarían decoloradas, no solamente las gram negativas y por lo tanto no podríamos diferenciar unas de otras.
Por último, aplicamos a la muestra la safranina y lo dejamos actuar durante otro minuto.

Transcurrido el minuto, volvemos a aclarar la muestra con agua destilada y dejaríamos que la muestra se secara.
Posteriormente observaremos la muestra con el microscopio.
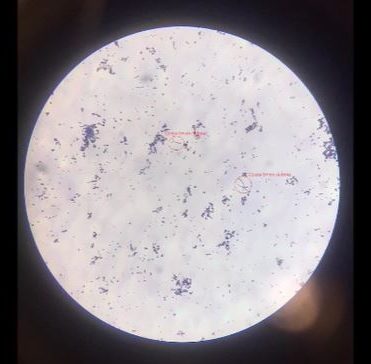
Vídeo explicativo Tinción de Gram
¡Recibe tu PDF con información sobre el Ciclo de Técnico Superior en Laboratorio Clínico y Biomédico modalidad presencial en Kapital Inteligente!:
Preguntas frecuentes sobre Tinción de Gram
¿Qué objetivo tiene la Tinción de Gram?
El objetivo de la Tinción de Gram es diferenciar bacterias según el grosor y la estructura de su pared celular, permitiendo clasificarlas en Gram positivas o Gram negativas.
¿Cómo se diferencia una bacteria Gram positiva de una Gram negativa?
Las Gram positivas retienen el color violeta del cristal violeta por tener una pared celular gruesa de peptidoglicano, mientras que las Gram negativas se decoloran y se tiñen de rosa o fucsia con safranina al tener una pared más fina y una membrana externa rica en lípidos.
¿Cuál es el orden correcto de los reactivos utilizados en la Tinción de Gram?
El orden es: cristal violeta (1 minuto), lugol (1 minuto), mezcla alcohol-acetona (10-15 segundos) y safranina (1 minuto), con lavados con agua destilada entre cada paso.
¿Qué precaución se debe tener al esterilizar el asa bacteriológica?
Después de calentar el asa hasta que esté incandescente, debe dejarse enfriar antes de tocar las colonias para no destruir los microorganismos.
¿Por qué es importante detener a tiempo la decoloración con alcohol?
Porque si no se interrumpe a tiempo, se eliminaría el colorante de todas las bacterias, impidiendo diferenciar entre Gram positivas y negativas.
